Virtuelles Design und Optimierung von alkalischen Elektrolyseuren mit AVL FIRE™ M
Veröffentlicht: März 25, 2025 · 1 Min. Lesezeit
Neben dem hohen Reifegrad bieten alkalische Elektrolyseure eine Reihe von weiteren Vorteilen:
- Kosteneffizienz in Produktion und Betrieb: z.B. durch unedle Katalysatormaterialien
- Hohe Lebensdauer: robust, auch für Großanlagen
- Skalierbarkeit: große Anlagen möglich
- Toleranz gegenüber Verunreinigungen: weniger Bedarf an Wasseraufbereitung
Insbesondere im Vergleich zu PEM-Elektrolyseuren gibt es aber auch einige Nachteile:
- Geringerer Wirkungsgrad
- Geringere Dynamik
- Sicherheitsbedenken: Gasübergänge, die zu einer Vermischung von Wasserstoff und Sauerstoff führen
- Größere Stellfläche: große Systeme
- Niederdruckbetrieb
Moderne Designs von alkalischen Elektrolyseuren (z.B. Zero-gap Design) und intelligente Betriebsstrategien haben das Potenzial, die Effizienzgrenzen teilweise zu überwinden. In diesem Zusammenhang kommt 3D-CFD ins Spiel, da es attraktive virtuelle Optimierungstechniken bietet.
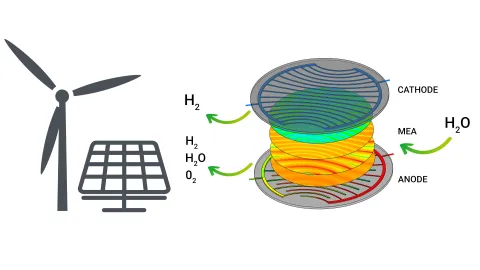
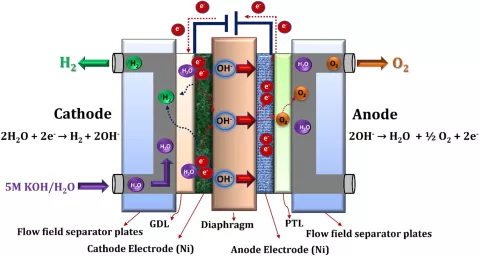
Die Kathode wird mit einem hochkonzentrierten flüssigen Elektrolyten (z. B. KOH in Wasser gelöst) gespeist. Die Elektrolytlösung wird dann entweder durch Strömungskanäle oder durch eine Art Verteiler (z. B. Streckmetallgewebe) zur Kathodenelektrode transportiert, wo das Wasser unter Verbrauch externer elektrischer Energie zu Wasserstoff und Hydroxidionen reagiert. Der erzeugte Wasserstoff verlässt das System durch den Kathodenauslass, während die Hydroxidionen über ein Diaphragma zur anodischen Elektrode transportiert werden, wo Wasser, Sauerstoff und Elektronen erzeugt werden. Theoretisch ist nur ein Einlass für den flüssigen Elektrolyten erforderlich. Aufgrund einer besseren Elektrolytzirkulation, die zu einem stabileren Betrieb und einer verbesserten Leistung führt, wird der flüssige Elektrolyt jedoch häufig sowohl der Kathode als auch der Anode zugeführt.
Eine der wichtigsten Komponenten des alkalischen Elektrolyseurs ist das Diaphragma, das als Separator zwischen den Elektroden dient. Hier wird ein poröses Material benötigt, das die folgenden Anforderungen erfüllt:
- Hohe Gasabscheideleistung
- Chemische Stabilität in der hochalkalischen Umgebung
- Mechanische und thermische Stabilität
- Geringer elektrischer Widerstand für den Ionentransport
- Lange Lebensdauer
Zu den gängigen Materialien, die für Membranen verwendet werden, gehören Asbest (historisch), Polysulfon und fortschrittliche Verbundwerkstoffe wie Zirfon, das Zirkoniumdioxid und Polysulfon für eine verbesserte Leistung kombiniert. Die Porengröße und Porosität liegen in der Regel im Bereich von 100 nm bzw. 50 %.
Als Katalysatormaterial werden in der Regel Nichtedelmetalle wie Ni verwendet.
Das Modell des alkalischen Elektrolyseurs in FIRE M umfasst die folgenden Transporteffekte:
- Zweiphasenströmung mit Kapillareffekten in porösen Medien, Phasenwechsel, Impulsaustausch Gas/Flüssigkeit und Elektroosmose
- Gasspeziestransport mit Mehrkomponentendiffusion
- Dreiphasiger Enthalpietransport mit dem porösen Feststoff als dritte Phase
- Transport gelöster Gasspezies im flüssigen Elektrolyten
- Elektronischer Ladungstransport in der festen Phase
- Transport von Ionenladungen und Ionenmassen in der flüssigen Phase
Die elektrochemischen Reaktionen, die in den Elektroden ablaufen, werden wie üblich mit der Butler-Volmer-Gleichung modelliert. Im Vergleich zum PEM-Elektrolyseur gibt es zusätzliche Terme für die Ionenkonzentration und die Flüssigwassersättigung. Das Modell basiert auf den folgenden Annahmen:
- Der Gasphasentransport und Phasenwechsel im Diaphragma wird nicht berücksichtigt, d.h. Gasspezies können das Diaphragma nur im gelösten Zustand passieren.
- Die Elektroden müssen porös sein, d.h. feste Elektroden werden nicht unterstützt.
- H2 und O2 werden im gelösten Zustand innerhalb des flüssigen Elektrolyten erzeugt und bilden entsprechend dem lokalen Phasengleichgewicht Gasblasen.
Im Gegensatz zu bisherigen Modellen, z.B. für PEM-Elektrolyseure, hat das Modell des alkalischen Elektrolyseurs eine höhere Flexibilität bezüglich der Position der Elektroden. Neben dem Zero-gap Design, d.h. die Elektroden berühren das Diaphragma, sind Lücken zwischen Diaphragma und Elektroden erlaubt.
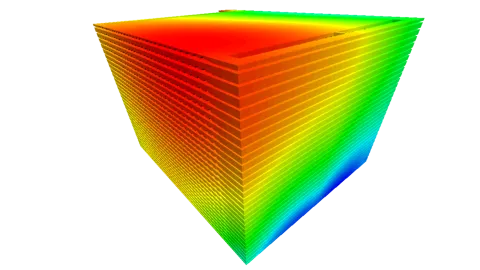
Eines der wichtigsten Ziele bei der Auslegung und Optimierung alkalischer Elektrolyseure (und aller Elektrolyseure und Brennstoffzellen im Allgemeinen) ist eine homogene Ionenstromdichteverteilung. Abbildung 3 zeigt die Geometrie, die Verteilung der Ionenstromdichte im Diaphragma sowie die relevanten Einflussgrößen, d. h. die Flüssigwassersättigung, die Temperatur und die Ionenkonzentration. Die Stromdichte nimmt von unten (Kanaleinlässe) nach oben (Kanalauslässe) ab. Der Hauptgrund dafür ist die Abnahme der Flüssigwassersättigung vom Einlass zum Auslass, da die Reaktionsgeschwindigkeit direkt proportional zur Wassersättigung ist. Die Flüssigwasserverteilung wird wiederum von der Stromdichte beeinflusst: Der Wasserverbrauch an der Kathode bewirkt eine Verarmung an flüssigem Wasser.
Ein zusätzlicher Effekt geht von der Schwerkraft aus, die zu einem stärkeren Ausgleich der Flüssigwassersättigung führt, indem sie das Wasser nach unten zieht und die Gasblasen nach oben drückt. Höhere Temperatur und höhere Ionenkonzentration sind ebenfalls direkt proportional zur Stromdichte, da sie die Reaktionsgeschwindigkeit und im Allgemeinen auch die Diffusions- und Leitfähigkeiten erhöhen. Beide Größen haben unten kleinere Werte und schwächen daher den Stromdichtegradienten ab.
Die Temperatur ist unten aufgrund der Kühlwirkung der Einlässe und an der Anode aufgrund des reversiblen Wärmebeitrags (Entropie) bei der elektrochemischen Reaktion geringer. Die Ionenkonzentration ist oben höher, da die bei der Kathodenreaktion erzeugten Ionen durch den Strom des flüssigen Elektrolyten nach oben gedrückt werden.
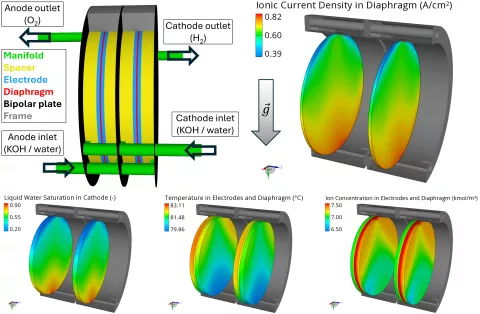
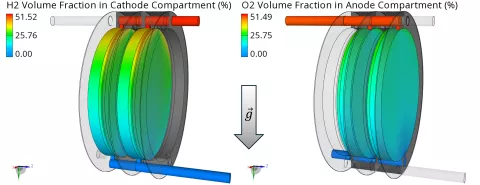
Abbildung 4 zeigt die Verteilung der Hauptgaskomponenten, d. h. H2 und O2, in den Hauptelektrodenbereichen, d. h. in den Elektrodenbereichen, in denen die Gaskomponenten erzeugt werden. Da H2-Blasen leichter sind als O2-Blasen, erfahren sie einen stärkeren Einfluss des Auftriebs, was zu einem größeren Volumenanteil im oberen Teil der Zelle führt.
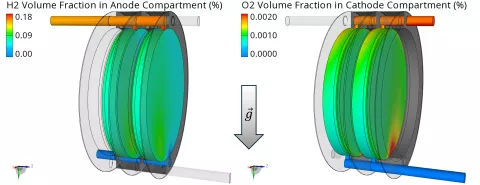
Die Volumenanteile von H2 und O2 in den gegenüberliegenden Elektrodenbereichen sind schließlich in Abbildung 5 dargestellt. Diese unerwünschten Gasansammlungen werden durch den Gasübergang über die Membran verursacht und sollten minimiert werden, um eine gefährliche Mischung von H2 und O2 zu verhindern. Offensichtlich ist die Anreicherung von H2 im Vergleich zu O2 viel höher. Die Gründe dafür sind ein schnellerer diffusiver Transport (größerer Diffusionskoeffizient für H2) und zusätzlicher konvektiver Transport aufgrund des elektroosmotischen Widerstands, der in Richtung der Anode wirkt.
In einem alkalischen Elektrolyseur sind mehrere Komponenten, wie Elektroden, Diaphragma oder Stromabnehmer, hinsichtlich Alterung und langfristiger Leistung kritisch, was hauptsächlich auf die aggressive alkalische Elektrolytlösung zurückzuführen ist. Außerdem können Verunreinigungen des flüssigen Elektrolyten die Leistung über einen längeren Zeitraum beeinträchtigen. Die Anforderungen an die Betriebslebensdauer alkalischer Elektrolyseure liegen bei 60.000 bis 90.000 Stunden. Daher sollte die Alterung der Komponenten so gut wie möglich vermieden werden. Um die Leistungsverluste in Abhängigkeit von der Lebensdauer vorherzusagen und die kritischsten Stellen und Betriebsbedingungen zu ermitteln, sind Degradationsmodelle erforderlich. Daher werden in Zukunft Degradationsmodelle für alkalische Elektrolyseure an das Performancemodell von FIRE M gekoppelt.
Alkalische Elektrolyseure werden höchstwahrscheinlich in den nächsten Jahrzehnten die führende Technologie bei der Herstellung von grünem Wasserstoff sein. Virtuelles Design und Optimierung mit Hilfe eines 3D-CFD-Tools sind eine entscheidende Grundlage für die Entwicklung und Verbesserung dieser Technologie. In diesem Artikel wurde das Modell des alkalischen Elektrolyseurs, das in der Version 2024 R2 von FIRE M enthalten ist, vorgestellt. Im Abschnitt über die 3D-Ergebnisse wurde der Einfluss der Wassersättigung, der Temperatur und der Ionenkonzentration auf die lokale Stromdichte gezeigt. Außerdem wurden die Verteilungen von H2 und O2 in der Gasphase dargestellt und die Auswirkungen des Gasübergangs aufgezeigt.
Verpassen Sie keinen Simulations Blog
Melden Sie sich noch heute an und bleiben Sie informiert!
Gefällt Ihnen das? Vielleicht gefallen Ihnen auch diese...
Verpassen Sie keinen Simulations Blog
Melden Sie sich noch heute an und bleiben Sie informiert!